研究背景
肿瘤转移是肿瘤致死的主要原因之一。肿瘤的转移包括肿瘤细胞的侵袭、存活、沉降和定植等一系列过程。原发部位和远端转移位点的微环境是肿瘤细胞散播和定植的重要驱动力。原发部位肿瘤可以调动和招募骨髓来源的细胞形成转移前微环境,为肿瘤细胞转移至远端部位提供趋化因子、生长因子和黏附因子,进而加速肿瘤转移。因此识别肿瘤驯化细胞,明确其功能是揭示肿瘤发生和转移的关键问题。
淋巴结是乳腺癌常见的转移部位,也是患者重要的预后指标。B 细胞是淋巴结重要的细胞之一,主要功能是产生免疫球蛋白,激活体液免疫反应。在肿瘤患者体内,B 细胞可以分泌肿瘤抗体,促进淋巴结转移,释放细胞因子抑制肿瘤免疫反应。
本项研究利用了上海伯豪生物技术有限公司提供的 Agilent G3 小鼠 8 *60 K 芯片服务,在揭示引流淋巴结(DLNs)中基因表达变化和相关通路富集的基础上,进一步的探讨了肿瘤驯化 B 细胞产生的病理性抗体 IgG 在肿瘤中的作用及其在淋巴结转移过程中的功能,对于理解乳腺癌肿瘤转移的分子机制至关重要。
研究内容
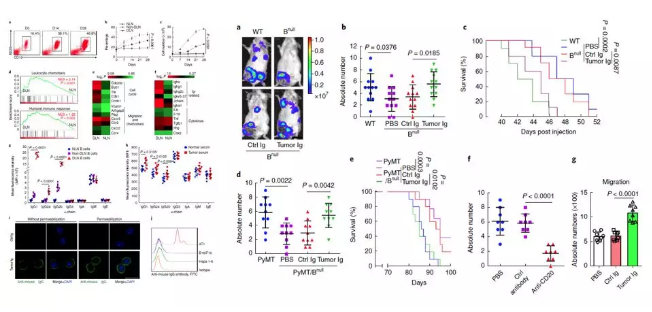
研究者利用小鼠乳腺癌接种 4T1 细胞模型,发现在 DLNs(引流淋巴结)中 B 细胞数量和比例显著增加。基因表达谱芯片数据显示细胞循环和迁移相关的基因表达水平升高,高表达基因主要富集在白细胞趋化和体液免疫应答两方面。
分析表明,肿瘤驯化 B 细胞产生 IgG 抗体的能力增加,携带肿瘤的小鼠血清中 IgG 也显著升高,并且该抗体可以靶向位于细胞膜的抗原。利用不产生 B 细胞的小鼠系体内功能实验证明,B 细胞缺失以后,淋巴结转移减少,生存期延长。重新输入 IgG 后携带肿瘤的小鼠淋巴结转移重新增加。因此表明,肿瘤驯化的 B 细胞可以产生病理性抗体,加速淋巴结转移。
为了进一步揭示病理性抗体 IgG 促进淋巴结转移的分子机制,一个趋化因子及其受体基因 CXXR4 和 SDF1α 及其相关基因表达情况被定量,这个趋化因子及其受体可以被病理性抗体 IgG 激活的机制得以阐释。
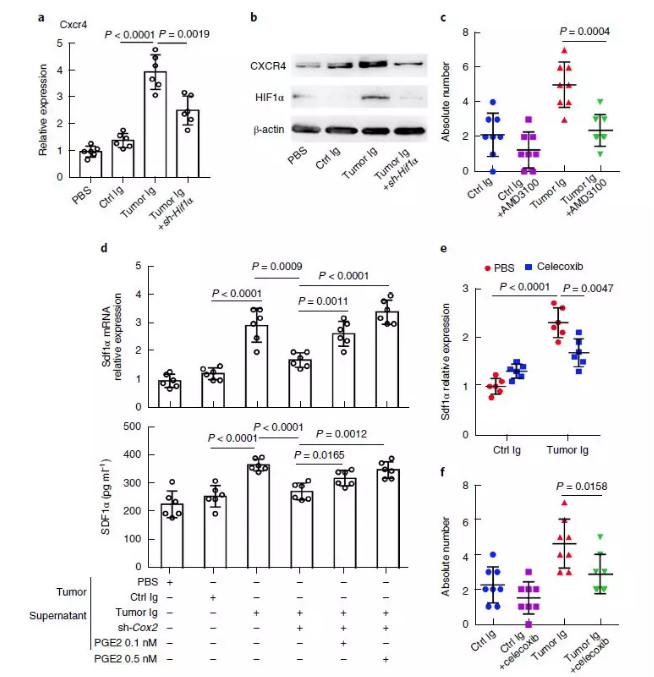
接下来的研究表明 IgG 可以激活 NF-κ B 通路,具体的分子机制是 IgG 可以结合糖基化的 HSPA4 蛋白,通过这种结合激活 CXCR4 和 SDF1α 趋化因子,从而激活 NF-κ B 通路。NF-κ B 通路的激活会上调靶基因 HIF1α 和 COX2 的表达,而 HIF1α 促进肿瘤细胞中趋化因子 CXCR4 表达水平升高,而 COX2 介导的 PGE2 分泌就会诱导淋巴结基质细胞分泌趋化因子受体 SDF1α,从而促进肿瘤细胞淋巴结转移。
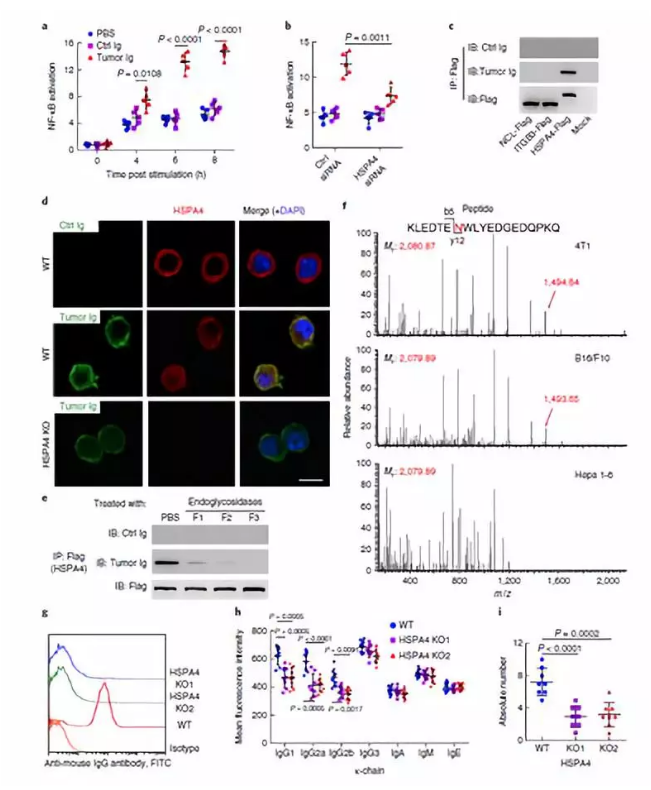
进一步的研究表明肿瘤细胞膜上糖基化的 HSPA4 与抗体 IgG 的结合,激活与 HSPA4 结合的膜蛋白 ITGB5,促进酪氨酸激酶 SRC 的磷酸化,从而激活下游的 NF-κ B 通路。
研究者通过对临床乳腺癌样本研究发现,乳腺癌患者血清中存在高浓度的 HSPA4 抗体,其基因高表达,这表达 HSPA4 可以是一个乳腺癌预后指标。

研究结论
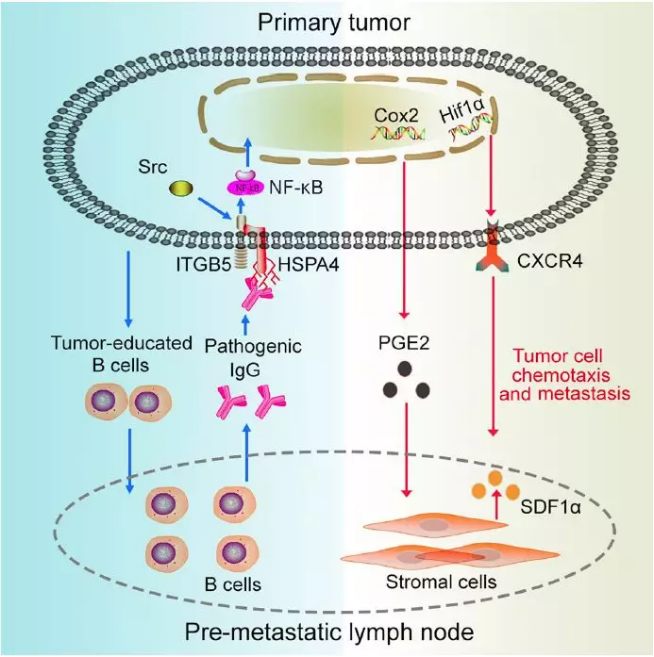
本研究阐明了肿瘤驯化 B 细胞产生病理性抗体 IgG 介导的体液免疫在创造淋巴结转移前微环境形成及淋巴结转移中的重要功能。B 细胞产生的病理性抗体可以与肿瘤细胞膜表面糖基化的抗原 HSPA4 结合,调控相关基因的表达,激活下游的 NF-κ B 通路,进而促进淋巴结转移。其重要意义是发现了一个潜在的预后指标肿瘤抗原 HSPA4 及其病理性抗体 IgG,对乳腺癌病人的预测和治疗提供了新的靶点。
-END-


