上一回,我们着重讲述了 有了 RNA-seq 还需要蛋白质检测吗? 其中几个关键参数大家一定记住了吧!比如在全基因组中,mRNA 和蛋白质表达水平之间的相关性很差,在许多研究中的解释力(explanatory power)徘徊在 40% 左右。这一回,我们来讲述如何进行蛋白质检测。
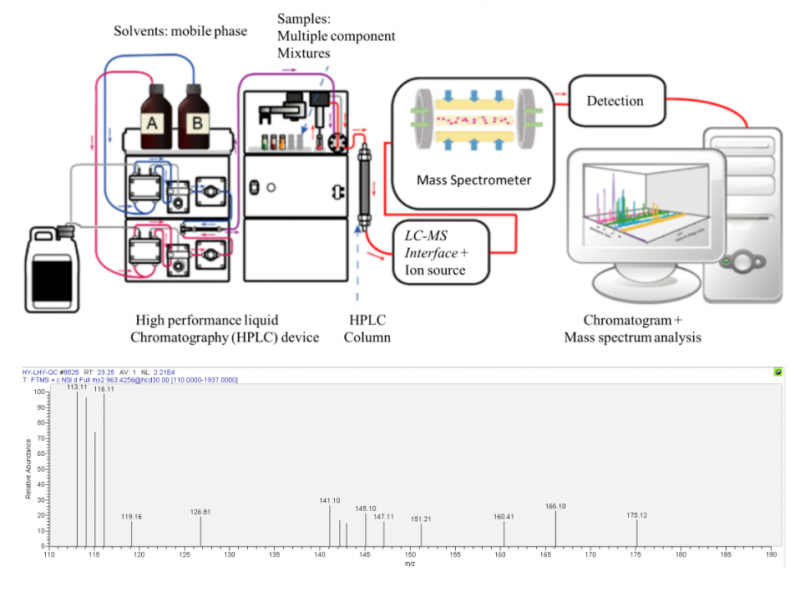
蛋白质检测首先我们想到的是质谱((mass spectrometry)技术。
质谱技术: 通过对化合物分子进行电离,生成不同质荷比(m/e)的离子,经加速电场的作用进入质量分析器。在质量分析器中,再利用电场和磁场使发生相反的速度色散,将它们分别聚焦而得到质谱图。质谱图中的横坐标表示离子的质荷比值,纵坐标表示离子流的强度。
蛋白质组学检测,在应用质谱技术的基础上发展了很多具体的方法:
不带标记的 label free
带标记的 iTRAQ(isobarictags for relative and absolute quantitation, 同位素标记相对和 jué对定量)
带标记的 TMT(Tandem Mass Tags, 串联质量标签)
非常高级的似乎全能的 DIA(Data Independent Acquisition, 数据非依赖性采集)
低通量的 PRM(Parallel Reaction Monitoring, 平行反应监视)
不带标记的 label free
Label free 是基础的了。与带标记的 iTRAQ 和 TMT 相比,样本不加标签,每个样本单独上机。只分析质谱数据,比较不同样品中相应肽段的信号强度,从而对肽段对应的蛋白质进行相对定量。由于它的技术原理所限,对仪器的稳定性、实验人员的操作等可能产生系统误差的因素要求极高,进而造成数据重现性较差。当然 label free 也有自己的优势,由于价格比较便宜,在临床实验时由于很多情况下都有十来个重复可以降低单个样品定量不准的风险,也就是说那种一测大几十个、上百个的时候还是可以选择的。还有一种情况,部分老师仅仅是想看看蛋白“有还是无”的,也是可以用 label free 的。还另有适用情况,比如泛素化修饰检测只能用 label free,这个我们后面讲修饰组的时候再细讲。
带标记的 iTRAQ/TMT
iTRAQ/TMT 是都是先将蛋白进行标记的,只是标记的基团不同。以 iTRAQ 举例说明,iTRAQ 即同位素标记相对和 jué对定量,使用同位素对不同样品进行标记,然后将同一批样品一起上机进行检测,根据不同的同位素标记来区分各个样品中 不同蛋白的表达量。优势是:定量准确,数据重现性好,灵敏度高对样品要求量低,检测蛋白数量多。缺点是由于同位素标记较多的只有 16 种(对,现在新出了 16 标的试剂盒!比以前同时标记的数量增加了),样品量大(不考虑生物学重复的实验点大于 16 个时)的时候需要在每次上机时加内参样品,增加了成本。样品量在不是特别多的情况下,iTRAQ/TMT 是目前做蛋白定量的技术。
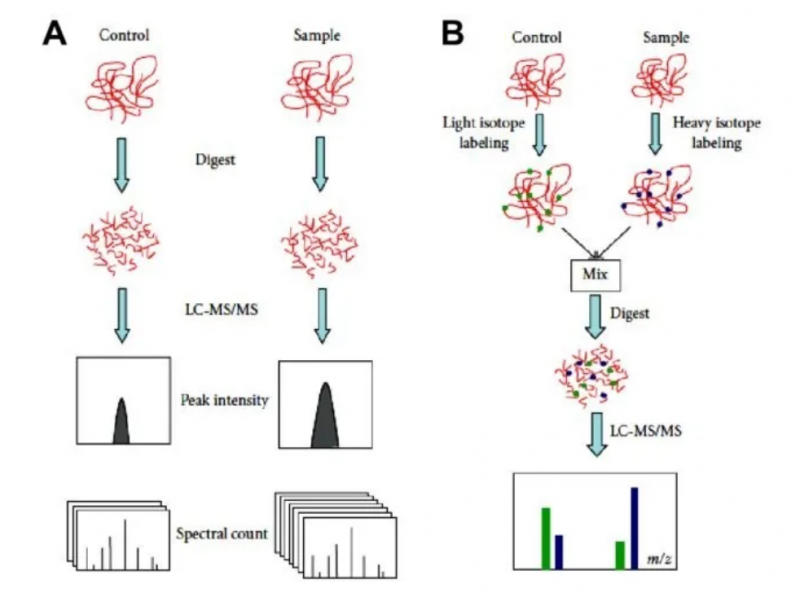
图 label free(A) 和稳定同位素标记定量(B) 之间的差异。Label free 定量包括两个独立进行的分析,然后进行比较。通过稳定同位素标记的定量可以直接比较同位素标记的肽对。LC-MS/MS,液相色谱 - 串联质谱联用。
非常高级似乎全能的 DIA 技术
和上面的三种技术,非常高级似乎全能的 DIA 技术是升级换代式的进步。上面的三种,采用的是 DDA(data-dependent acquisition,数据依赖采集)数据采集方式,其策略是对响应高的部分母离子进行二级采集。而 DIA(Data Independent Acquisition,数据非依赖采集)采用了不同的数据采集模式:将质谱整个全扫描范围分为若干个窗口,然后对每个窗口中的所有离子进行检测、碎裂,从而无遗漏、无差异地获得样本中所有离子的信息,实现了从传统的机枪扫射的方式向导弹轰炸方式的采集方式转变。
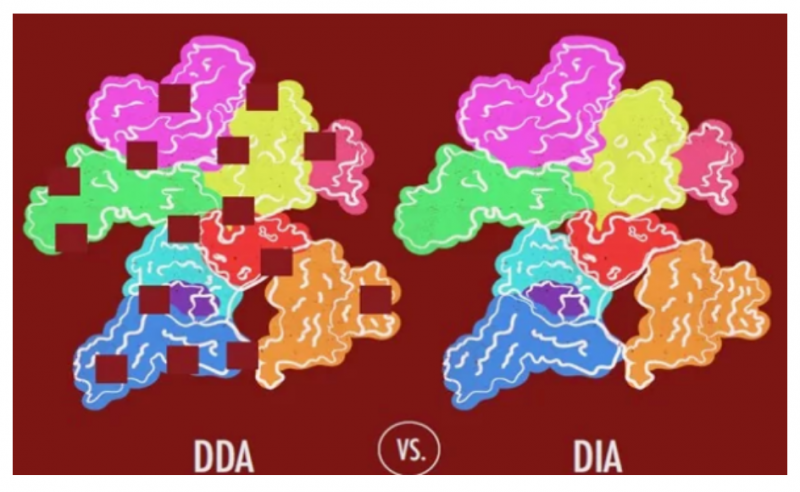
特别是对于血液,含有像白蛋白这样的高丰度蛋白。在常规质谱分析中,那些高丰度的蛋白常常会将具有意义的低丰度蛋白掩盖。而 DIA 技术,无需去除高丰度的蛋白。
当然,DIA 也有其弱点,比如对仪器的要求、价格等。所以,也不能完全取代之前的技术。要根据需求选择。
低通量的 PRM
PRM 能够对目标蛋白质、目标肽段(如发生翻译后修饰的肽段)进行选择性检测,从而实现对目标蛋白质 / 肽段进行 jué对定量。也就是说,是靶向的定量技术。PRM 和上述的几种技术相比,就相当于 qPCR 之于二代测序。因此,可以用来验证蛋白质组的结果。当然,qPCR 做验证,一般是做的单重 qPCR,而 PRM 可以轻松上到多重,我们试过一次检测 50 个靶标。我们“古早”的蛋白验证技术,像 Western Blot,可以被 PRM 代替的,而且 PRM 也不需要一抗。如果需要检测的蛋白多,经济上算起来,PRM 更划算呢!
当然,基于质谱蛋白检测应用发展的还有其它技术。上面介绍的 5 种技术是用得较多的。检测蛋白的技术,可能还会想到免疫。当然我们这里要介绍的不是 Western Blot、ELISA 等传统的免疫技术,而是高通量的蛋白芯片以及低通量的液相悬浮芯片。
蛋白芯片 类似于基因芯片,固相的板面上有整齐地排列着一个一个小点,这些小点可能是各种抗体,也可能是各种基因组的蛋白质。通过抗原抗体及显色反应,芯片上显出或者亮或暗的点,以此筛查各种信号通路、蛋白表达。

液相悬浮芯片 ,我们前面介绍过 还不知道液相悬浮芯片?你 OUT 啦! 在蛋白检测中的应用,主要是各种细胞因子检测,即 Merck Millipore 公司的 Milliplex 高通量蛋白因子检测芯片。它是一块 96 孔板,每个孔里有偶联上不同抗体的微珠。上样后,经过抗原抗体反应和显色反应,可以得出每个样本的不同因子的量。
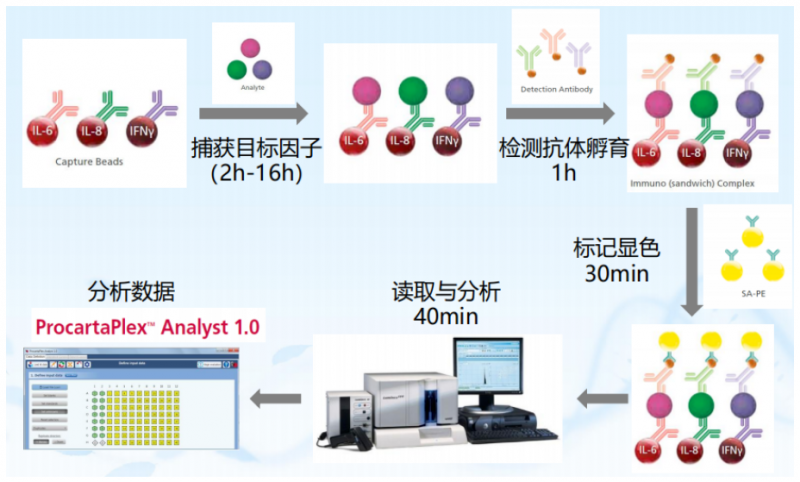
细胞因子(cytokines)是由免疫细胞(如单核、巨噬细胞、T 细胞、B 细胞、NK 细胞等)和某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质。也就是说,Miliplex 检测的是各种液体,包括体液、灌洗液。
以上,我们介绍了基于质谱和基于免疫反应两大类常见的蛋白质检测技术。下面几回,我们会进行一些案做的分享。 有了 RNA-seq,,还需要蛋白质检测吗?

