空间转录组测序实验流程
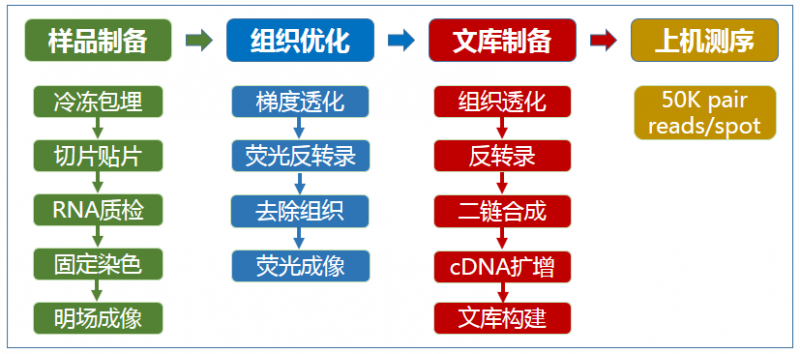
图 10X Genomics Visium 实验流程
空间转录组测序每个实验步骤所需要注意的事项
1、新鲜组织样本包埋
目前新鲜组织的包埋方法有两种,一种是液氮 + 异戊烷法;另一种的干冰法。对于临床手术切下来的组织样本一般使用干冰的包埋方法。对于穿刺样本等一些较小,较轻的样本,一般推荐用液氮 + 异戊烷的方法进行冷冻。OCT 包埋组织块可以在–80ºC 的密封容器中长期保存,或立即进行冷冻切片。
2、冷冻切片切、组织样本质控及贴片
由于空间转录组检测的是组织中的 RNA,因此要对切片中的 RNA 质量进行检测。我们一般取 10 片组织切片进行 RNA 抽提并质检,确定组织中 RNA 完整性(RIN>7)。所以要求我们的组织样本要保证可以切到至少 20 片 10um 厚度的切片,以便完成所有的实验。
3、组织优化
组织优化的目的是摸索样本的透化条件,保证组织切片中的 mRNA 能够充分释放。该步骤是获取真实实验结果的必要条件。否则,我们无法判断是基因表达高低到底是因为透化不充分导致的,还是实际就是这个样子。因此:每个样本建议都要做透化,尤其是临床样本。
4、成像
应使用 Visium Imaging Test Slide 验证成像设置。明场成像基准框和基准标记应清晰可见,并使用 Brightfeld 设置聚焦。Visium Imaging Test Slide 四个区域(A1,B2,C1,D2)具有荧光斑点,可通过 TRITC 和 Cy5 flter cubes 检测到,荧光设置应清晰可见 A1,B2,C1 和 D2 中的荧光点,且荧光点信号应从左到右减小。
5、正式实验
正式实验时要对反转录后的 cDNA 长度分布,浓度和量进行判断。cDNA 的长度分布在~200bp-9000bp 之间,在 1000bp 左右会有峰值(不同的组织类型会有些许差异)。
6、测序
在捕获区域,每个组织覆盖的 spot 建议至少测 50000 read pairs。整个捕获区域共有 5000 个 spots。可以根据组织贴到芯片上后,覆盖芯片的大小来判断测序的数据量。
计算公式(Coverage Area x total spots on the Capture Area)x 50,000 read pairs/spot 例如:组织覆盖了 60% 的区域,则数据量为(0.60 x 5,000 total spots) x 50,000 read pairs/spot=150 million read pairs。

图 切片覆盖芯片区域百分比
更多伯豪生物人工服务:


