
期刊:CELL
影响因子:66.85
技术服务:scRNA-seq
导 读
尽管以 T 细胞为中心的免疫疗法已经取得了无可争议的临床成功,但数量有限的获得持久响应的患者迫切需要补充的治疗策略。NK 细胞,作为肿瘤微环境中一类重要的组成部分参与肿瘤控制的多个过程,如直接的杀伤细胞和分泌促炎因子等。利用 NK 细胞进行癌症治疗已提出了大量的策略,其特点是有希望的特性,包括其安全性和有效性。特别值得注意的是,嵌合抗原受体(CAR)- NK 细胞治疗淋巴瘤、骨髓瘤和白血病取得了显著的临床成功。然而,基于 NK 细胞的治疗在实体瘤中受到阻碍,部分原因是对肿瘤浸润性 NK 细胞的了解不完全,特别是它们对肿瘤的浸润、表型异质性和 TME 内的失调。
人体中的 NK 细胞可被划分为 2 种主要的类,CD56dimCD16hi 和 CD56brightCD16lo,主要基于 CD56 (NCAM1) 和 CD16 (FCGR3A) 的表达水平。CD56dimCD16hi NK 细胞群主要通过分泌穿孔素和颗粒酶介导靶细胞的杀伤,而 CD56brightCD16lo NK 细胞群表现出免疫调节和细胞因子产生能力。近期,单细胞 RNA 测序技术促进了肿瘤浸润免疫细胞异质性的表征,为阐明肿瘤浸润 NK 细胞亚群的图谱提供了很大机会。例如,我们鉴定了 CD160+HSPA1A+ 肝常驻细胞亚型在肝细胞癌中的特异性富集,其他人则报道了出现在黑色素瘤中浸润的特异的 NK 细胞亚群具有区域性差异。同时,人类 NK 细胞在在健康组织和血液中的分布和功能也得到了研究。然而,对于肿瘤浸润的 NK 细胞,大多数单细胞 RNA 测序的规模是有限的,并且它们在恶性疾病中获得的异质性表型的程度仍不清楚。
与 CD8+ T 细胞相比,NK 细胞作为细胞毒性活性的替代来源,以低突变负荷和主要组织相容性复合体(MHC) I 类异常表达来对抗肿瘤细胞。尽管 CD8+ T 细胞的功能失调状态以细胞毒性降低和多种抑制受体的高表达为特征,但 NK 细胞功能失调尚未得到详细研究。此前,肝癌中有 NK 细胞功能低下的报道,但尚未分析其免疫调节机制,其他癌症类型是否也存在这种现象尚不清楚。此外,尽管 TIGIT 和 TIM3 在肿瘤浸润性 NK 细胞中的抑制作用已经明确,但其他免疫检查点如 PD- 1 和 CTLA4 是否在这些细胞中发挥同样的作用甚至表达仍然存在争议。此外,NK 细胞对 TME 的免疫抑制因子敏感,这可能导致它们的功能失调的表型,但不同的调节过程如何影响不同癌症类型的 TME 中 NK 细胞的功能和丰度尚不清楚。总之,这些促使我们对 NK 细胞进行深入研究,以阐明它们在泛癌症水平上的异质性和功能障碍。
在这里,我们收集了广泛的已发表和新生成的 scRNA-seq 数据,构建了一个全面的肿瘤浸润人类 NK 细胞图谱,并探索了 NK 细胞在不同癌症类型和组织中的异质性。我们揭示了肿瘤浸润 NK 细胞状态的转变,并强调了可能导致 NK 细胞功能障碍的 TME 成分。这些数据将为促进对主要癌症类型中 NK 细胞的整体特性的理解提供丰富的资源,并为基于 NK 细胞的免疫治疗的发展提供有价值的见解。
技术服务
研究结果
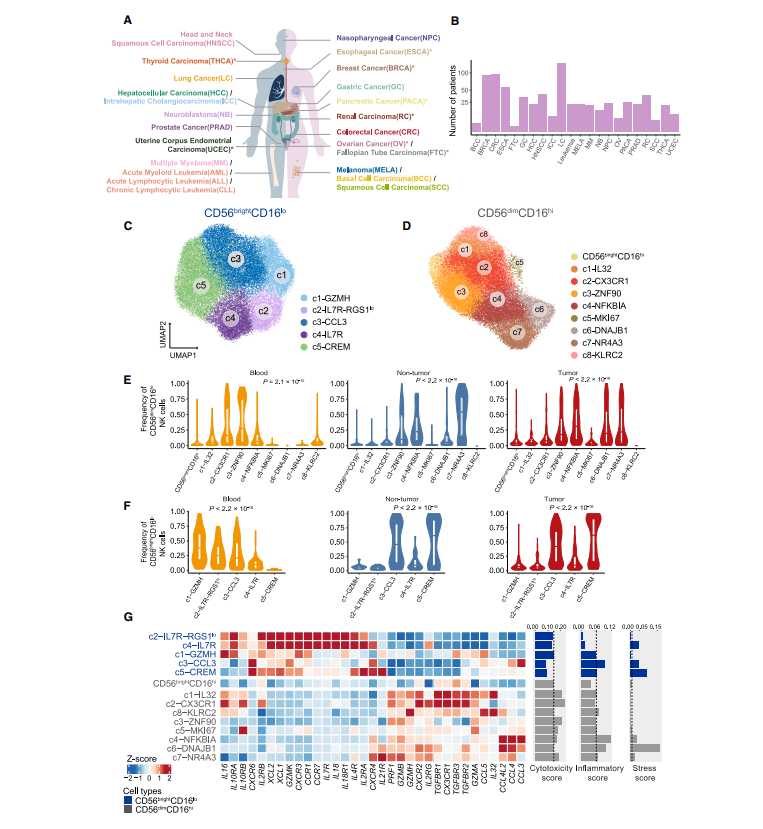
1. 在单细胞分辨率水平下构建人类泛癌 NK 细胞图谱
为肿瘤浸润 NK 细胞构建一个综合的泛癌单细胞转录组图谱,我们首先从我们新生成的数据集中收集了 47 名诊断为 8 种癌症类型之一的患者的 scRNA-seq 数据和 70 个其他已发表的数据集。这些数据覆盖了 24 种癌症类型,包括来自 716 个病人的 1223 个样本,包括肿瘤、临近非肿瘤组织、外周血、和其他组织如淋巴结,以及 60 名健康对照样本(图 1A-B)。经过严格的质控和计算门控(CD3CD56+/KLRF1+) 及非监督聚类结合的方法,本研究中我们获得了 160011 个高质量的 NK 细胞,包含 11963 个新生成的 NK 细胞。值得注意的是,考虑到肿瘤组织内 NK 细胞在 CD45+ 细胞中相对较少,对它们的异质性了解的较少,因此,构建如此大规模的 NK 细胞图谱是必不可少且有挑战性的。与先前的来自人血液和脾脏的 7000 个 NK 细胞构建的 NK 细胞单细胞转录组图谱相比,我们的规模扩大了 20 倍,代表了大多数主要的癌症类型和多种组织。
为了无偏的定义 NK 细胞的泛癌群体结构,我们整合了数据集之间最小批次效应的单细胞 RNA 数据,并进行了 2 轮无监督聚类。第一轮分析涉及区分两种特征明确的主要细胞类型,CD56brightCD16lo 和 CD56dimCD16hi,主要基于高表达的典型细胞标记 NCAM1 和 FCGR3A,分别对应于先前报道的“NK_1”和“NK_2”群体。CD56brightCD16lo 区可以进一步细分为 5 个子集,而 CD56dimCD16hi 区在第二轮聚类中被识别出 9 个子集(图 1C-D)。我们没有观察到两种主要大群在不同癌症类型或不同亚群中 KLRF1 的表达有显著差异。值得注意的是,之前报道的 ILC 细胞标记基因几乎不在这些 NK 细胞亚群中表达,表明了我们数据的纯度。这些亚群的特点是在每个主要群体中都有不同的特征基因的高表达。正如预期的那样,先前描述的亚群很容易在我们的图谱中被识别出来,例如 CD56brightCD16lo c5-CREM 亚群伴随着 CREM 高表达。伴随着 KLRC2 (NKG2C) 的高表达的 CD56dimCD16hi c8-KLRC2 NK 细胞亚群被视为适应性的 NK 细胞。我们的图谱还发现了几个被低估的 NK 细胞亚群,它们具有独特的转录表型。例如,CD56dimCD16hi c5-MKI67 以 MKI67 和 STMN1 等增殖标志物的高表达为特征,CD56dimCD16hi c6-DNAJB1 特异性表达与应激反应相关的基因。我们的图谱还在几乎所有癌症类型中捕获了低比例的 CD56brightCD16hi NK 细胞,同时表达高水平的 NCAM1 和 FCGR3A。CD56brightCD16hi NK 细胞表现出介于 CD56brightCD16lo 和 CD56dimCD16hi NK 细胞之间的中间特征,可能代表了类似于小鼠 CD27+CD11b+ NK 细胞的发育中间体,这也被认为是小鼠的短暂成熟阶段,但 scRNA-seq 几乎无法检测到。接下来,我们检查了所有亚群的组织分布,观察到不同的组织富集模式,表明我们的综合分析可以保留不同组织的异质性 (图 1E-F)。为了进一步证实聚类的稳定性,我们将血液、肿瘤和邻近非肿瘤组织中的 NK 细胞分别重新聚类,结果显示高度一致。最后,利用可以测量细胞簇纯度的全局未移位熵比(ROGUE) 指数,表明所有这些群体在各种癌症类型中都是稳健的。
NK 细胞亚群参与了不同的发育阶段,其共同谱系特异性基因的表达揭示了这一点。肿瘤中富集的 CD56bright CD16lo c4-IL-7R 和血液中富集的 c2-IL-7R-RGS1lo 细胞,高表达 NK 细胞前体标志物,都是在发育早期绘制的。相比之下,其他未成熟的 CD56brightCD16lo 亚群表现出前体标志物的逐渐减少和 CD160 表达的大量增加。更成熟的 CD56dimCD16hi 亚群,特别是 c6-DNAJB1 和 c7- NR4A3,除了 FCGR3A 和 B3GAT1 (CD57) 外,还表现出杀伤免疫球蛋白样受体(KIR) 家族的上调。不同发育状态的 NK 细胞亚群在肿瘤中同时存在,表明 NK 细胞向肿瘤的迁移可能与 NK 细胞成熟解耦有关。
我们进一步检查了基因表达特征,以破译不同群体之间的功能差异(图 1G)。CD56dimCD16hi NK 细胞高表达细胞毒效应基因,包括穿孔素(PRF1) 和除 GZMK 外的大多数颗粒酶(GZMB、GZMA 和 GZMH),而 GZMK 只在 CD56brightCD16lo NK 细胞中表达。CD56brightCD16lo NK 细胞表达多种细胞因子基因,如 IL18。我们还观察到 CD56brightCD16lo c2 和 c4 同时表达 il -18 及其受体 IL18R1,这意味着 il -18 依赖性自分泌途径在这些亚群中可能起着至关重要的作用。引人注目的是,CD56dimCD16hi NK 细胞亚群也可以表现出某些细胞因子的特异性表达,但与 CD56brightCD16lo 亚群具有不同的模式。特别是,CD56dim CD16hi 亚群 c4-NFKBIA 在所有 NK 细胞亚群中表现出相对较高的炎症评分,主要表达 CCL3、CCL4 和 CCL4L2,表明它们有能力招募其他免疫细胞,如 T 细胞。最近的研究将 1 型常规树突状细胞(cDC1s) 募集到肿瘤与 NK 细胞联系起来,通过 NK 细胞分泌 XCL1、XCL2 和 CCL5 来实现。我们的研究鉴定出了通过细胞类型特异性互补策略参与 cDC1 募集的多种 NK 细胞亚群。CD56brightCD16lo c2 和 c4 表达初级水平的 XCL1 和 XCL2,而 CD56brightCD16lo (c1-GZMH 和 c3-CCL3) 和 CD56dimCD16hi (c1-IL-32 和 c8-KLRC2) NK 细胞优先表达另一个 cDC1 趋化基因 CCL5。此外,我们描述了激活和抑制受体的概况,观察到 NK 细胞亚群的明显变化。例如,KLRC1 在 CD56brightCD16lo NK 细胞中的表达水平高于 CD56dimCD16hi NK 细胞,尽管不是特异性的,LAG3 和 TIGIT 在 c8-KLRC2 中高表达。值得注意的是,与其他组织富集的 CD56dimCD16hi 亚群(c4-NFKBIA, c5-MKI67 和 c7-NR4A3) 相比,c6-DNAJB1 NK 细胞表现出最高的应激评分和最弱的细胞毒性,表明它们的转录和功能表型存在显著差异(图 1G)。综上所述,我们以细粒度的亚群分辨率提供了 NK 细胞的详细转录组谱。而不是分析 NK 细胞作为一个单一的群体,我们剖析 NK 细胞的亚群特异性分子特性,并揭示其未被重视的异质性。
2. 不同肿瘤类型 NK 细胞的组织异质性
接下来,我们评估了肿瘤浸润 NK 细胞群在不同癌症类型中的偏好,观察到明显的差异(Figure 2A)。例如,未成熟的 CD56brightCD16lo NK 细胞在鼻咽癌和基底细胞癌中占主导地位,而成熟的 CD56dimCD16hi NK 细胞在肾癌和肺癌中占主导地位,这与先前的报道一致。其他的,如结直肠癌和肝癌,没有明显的倾向(图 2A)。为了检验上述趋势是否可以用器官结构来解释,我们分析了邻近非肿瘤组织中主要 NK 细胞类型的内在组成及其在肿瘤中的相应变化。在某些类型的癌症中,如结直肠癌,肿瘤组织的 NK 细胞组成与邻近的非肿瘤组织相似。在肺癌、肾癌等肿瘤类型中,尽管肿瘤与邻近非肿瘤组织中主要 NK 细胞类型保持不变,但 CD56dimCD16hi NK 细胞的比例明显降低(图 2B)。有趣的是,乳腺癌和食管癌肿瘤主要的 NK 细胞群与它们的邻近非肿瘤组织相比是相反的(图 2C)。这些观察结果表明,内部器官特性和恶性肿瘤相关因素对形成 NK 细胞群的成分有复合的影响。
我们进一步从子集的角度探索 NK 细胞的癌症类型特异性,并进行无监督聚类,根据 NK 细胞亚群比例对所分析的癌症类型进行分层。NK 细胞亚群如 c2-CX3CR1 在胰腺癌、乳腺癌和黑色素瘤中表现出强烈的偏好。在某些亚型的癌症类型中观察到高变异性。例如 c4-NFKBIA 和 c7-NR4A3 从头颈部鳞状细胞癌和甲状腺癌到食管癌和鼻咽癌的中位数频率显著降低(图 2D)。尽管观察到明显的差异,但包括子宫内膜癌、基底细胞癌和食管癌在内的癌症类型聚集在一起,均具有丰富的 CD56brightCD16hi c5-CREM 和较少的 c4-IL-7R NK 细胞。特别值得注意的是,具有上述低饱和度阶段的罕见 CD56brightCD16hi NK 细胞亚群在黑色素瘤和白血病中大量存在,特别是在急性髓系白血病(AML) 亚型中(图 2D)。NK 细胞的这种低饱和度阶段与 AML 患者的总生存期和无复发生存期的降低有关。与其他 NK 细胞群相比,这些 CD56brightCD16hi 细胞在其极低的激活和抑制受体评分方面表现出独特的表型和功能变化(图 2E)。目前基于 NK 细胞的治疗侧重于增强 NK 细胞的激活和寿命,但通常忽略了癌症类型之间的异质性和 TME 对 NK 细胞细胞毒性功能的抑制作用,这些都应该在未来的治疗策略中加以考虑。

3. RGS1 是组织浸润 NK 细胞的标志
如上所述,NK 细胞成分从血液到组织都发生了显著变化。同样,在组织浸润 NK 细胞和它们的血液对应物之间检测到广泛的转录变化(图 3A-B)。先前的研究已经确定了组织驻留 NK 细胞的几种标记物,如 CD69、CD103、CXCR6 和 CD49a。然而,我们发现 ITGA1 (CD49a)、ITGAE (CD103) 和 CXCR6 在单细胞转录组水平很少被检测到,CD69 在 NK 细胞中广泛表达,包括血液来源的(图 3E)。此外,有报道显示,这些标记物在特定组织的 NK 细胞群中优先表达。这些促使我们以无偏的方式从泛癌的角度发现强大的 NK 细胞驻留标记。
我们选择了血液和组织之间的差异表达基因,并进一步评估了它们的敏感性和特异性,以区分 NK 细胞的组织来源。因此,RGS1 (G 蛋白信号 1 的调节因子)被明确识别,它只在肿瘤和邻近非肿瘤组织的 NK 细胞中表达,而在血液中几乎检测不到(图 3C-D)。此外,RGS1 的表达与 KLF2、SELL 等迁移信号相反(图 3E)。与上述常规组织驻留标记相比,RGS1 具有更高的敏感性和特异性。接下来,我们直接比较了 RGS1 与 ITGAE、CD69 及其联合在血液中的表达模式,发现 RGS1 单独在血液中的检出率最低,而 RGS1/CD69 联合可以进一步提高组织中的阳性检出率(图 3F)。此外,RGS1/CD69 联合在区分血液和非血液 NK 细胞方面比单独使用具有更高的曲线下面积(AUC) 值。值得注意的是,RGS1 在分析的患者和癌症类型中广泛表达(图 3G-H)。
综上所述,这些特征暗示了 RGS1 单独或与 CD69 结合的潜在作用,在转录组水平上是组织浸润 NK 细胞的优良标记物。我们推测 RGS1 的表达可能减弱 G 蛋白的信号活性,导致 NK 细胞趋化迁移能力减弱,促进 NK 细胞驻留。RGS1 在 NK 细胞中的作用机制有待进一步研究。

4. 肿瘤相关 NK 细胞程序及其特征
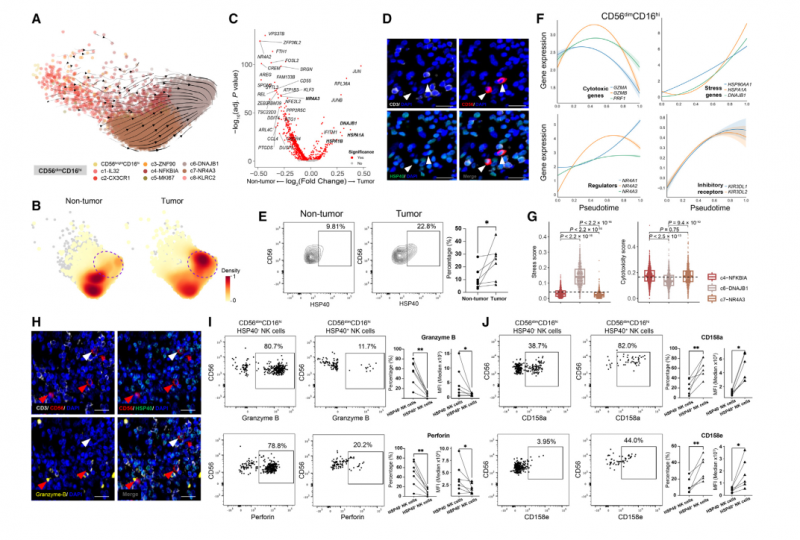
接下来,我们试图阐明 NK 细胞在肿瘤中的明确特征。除了上述某些亚群在肿瘤特异性富集外,我们发现,与邻近的非肿瘤组织相比,在肿瘤中,CD56brightCD16lo c3-CCL3 NK 细胞的细胞因子产量较低,表现为 CCL3 和 CCL4 的表达减少,并且在大多数癌症类型中,c5-CREM NK 细胞中 XCL1 和 XCL2 的表达减少,暗示它们在肿瘤中的功能转换。然后,我们使用 SCENIC 识别了肿瘤浸润性 CD56brightCD16lo 和 CD56dim CD16hi NK 细胞亚群的激活调控子。重要的是,肿瘤富集的 c6-DNAJB1 亚群表现出更高的转录因子如 KLF6 和 EGR3 的表达,这些转录因子与细胞毒性功能的抑制有关。
利用 RNA 速率,我们解码了 NK 细胞的转录动力学,在 CD56brightCD16lo 和 CD56dimCD16hi NK 细胞中观察到从血液富集的亚群到肿瘤浸润群的明确定向流动(图 4A)。相应的,RGS1 的表达沿流速方向升高。我们发现 CD56dimCD16hi c6-DNAJB1 NK 细胞位于速率末端,从而推断为终末状态(图 4A)。值得注意的是,来自邻近非肿瘤组织的 CD56dimCD16hi NK 细胞主要观察到在 UMPA 图上富含 c7-NR4A3 细胞;相比之下,肿瘤来源的 CD56dimCD16hi NK 细胞在富含 c6-DNAJB1 细胞的 UMAP 图上占优势地位(图 4B)。与此一致的是,肿瘤富集的 c6- DNAJB1 NK 细胞的标记物,如 DNAJB1 和 HSPA1A 在肿瘤浸润的 CD56dimCD16hi NK 细胞群中高度表达(图 4C)。此外,我们观察到 c6-DNAJB1 和 c7-NR4A3 NK 细胞中线粒体基因的表达水平相似,表明 c6-DNAJB1 NK 细胞的应激表型与细胞质量无关。由于 c6-DNAJB1 细胞在肿瘤中特异性富集,我们将这一群体称为肿瘤相关 NK (TaNK) 细胞。
多重免疫荧光染色进一步证实了肿瘤中 TaNK 细胞的存在(图 4D)。我们还利用流式细胞术验证了 TaNK 细胞(CD56dimCD16hi HSP40+) 在体内肿瘤的富集。在 1 例肝内胆管癌和 6 例 HCC 样本中,我们发现了 TaNK 细胞,它们在肿瘤浸润性 CD56dimCD16hi NK 细胞中的比例高于对应的邻近肝组织,这与我们的 scRNA-seq 数据一致(图 4E)。
然后,我们使用拟时序推断分析来研究 CD56dimCD16hi NK 细胞的动态,发现 TaNK 细胞在 CD56dimCD16hi NK 细胞的推断拟时间内越来越多地出现,并且在终末期富集,与 RNA 速率分析的结果一致。为了检验 TaNK 细胞的新特征,我们将基因表达谱与拟时间拟合。有趣的是,CD56dimCD16hi NK 细胞在过渡过程中表现出细胞毒性降低,抑制受体和应激基因表达升高(图 4F)。
值得注意的是,在所有肿瘤浸润的 CD56dimCD16hi NK 细胞亚群中,末端 TaNK 细胞具有最低的细胞毒性和最高的应激评分。相比之下,相应的 c7- NR4A3 在邻近的非肿瘤组织中富集,具有高度的细胞毒性(图 4G)。通过对几种癌症类型进行多重免疫荧光染色,我们观察到 TaNK 细胞表现出较低水平的 GZMB (图 4H)。肝癌患者流式细胞术分析进一步证实,与 CD56dimCD16hi HSP40+ NK 细胞相比,TaNK 细胞肿瘤部位细胞毒性颗粒(颗粒酶 B 和穿孔素)表达较低,抑制受体 CD158a (KIR2DL1) 和 CD158e (KIR3DL1) 表达较高(图 4I -J)。这些结果表明,TaNK 细胞可能与功能失调状态有关。此外,我们还观察到 NR4A 核受体家族随着拟时间顺序的增加而呈现的动态差异趋势(图 4F)。c7-NR4A3 NK 细胞高表达 NR4A2 和 NR4A3,而 TaNK 细胞高表达 NR4A1。有趣的是,NR4A1 已被确定为 T 细胞功能障碍的关键介质,并被认为有助于限制实体瘤中 CAR - T 细胞的功能。总之,我们的数据表明,肿瘤中的 TaNK 细胞可能最终功能失调,并可能在 TME 中发挥关键作用。
5. TaNK 细胞与不良预后和免疫治疗耐药的关系
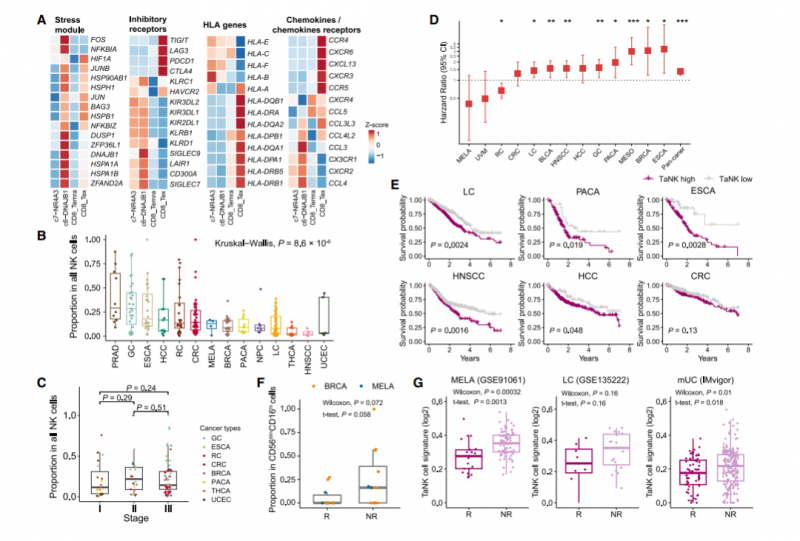
由于 NK 细胞和 CD8+ T 细胞表现出广泛的表型和功能相似性,我们接下来研究了靶向 CD8+ T 细胞的免疫检查点阻断(ICB) 疗法是否也会影响 NK 细胞。在肿瘤浸润性 NK 细胞和 CD8+ T 细胞中,TaNK 细胞和耗竭 T 细胞(Tex) 表现出明显的应激状态(图 5A),提示它们参与肿瘤免疫应答。均高度表达一系列抑制受体分子;然而,它们在各种免疫调节基因上具有不同的表达谱。传统的免疫检查点基因如 PDCD1 和 CTLA4 在 TaNK 细胞上几乎不表达(图 5A),这意味着它们不是抗 PD -1/CTLA- 4 治疗的直接靶点。因此,在 TME 和当前的 ICB 治疗中,TaNK 细胞可能与 Tex 细胞发挥不同的作用。
我们观察到不同癌症类型的 TaNK 细胞丰度存在显著差异(图 5B),肿瘤时期对 TaNK 细胞比例的影响很小(图 5C)。值得注意的是,在癌症基因组图谱(TCGA) 数据集中,肿瘤中的高 TaNK 细胞信号与大多数癌症类型的低生存率相关(图 5D-E)。我们进一步应用基于深度学习的模型进行反卷积和细胞组成分析,发现高 TaNK 细胞频率表明癌症患者预后不良。此外,我们通过分析先前乳腺癌和黑色素瘤的 ICB 治疗研究中预处理肿瘤的 scRNA-seq 数据,进一步研究了 TaNK 细胞是否与 ICB 治疗应答相关(图 5F)。引人注目的是,在两种癌症类型中,无应答患者中观察到的 TaNK 细胞比例高于应答患者。进一步利用来自各种癌症(包括黑色素瘤、肺癌、转移性尿路上皮癌)的已发表的大量数据,我们验证了无应答患者比应答患者表现出更强的 TaNK 细胞信号(图 5G)。
我们推测,长期浸润可能赋予肿瘤中 TaNK 细胞的功能状态,导致其对恶性细胞的无效杀伤。TaNK 细胞的富集与对抗肿瘤的免疫反应受损以及对当前 ICB 治疗的低敏感性有关。我们的发现揭示了 TaNK 细胞在肿瘤中的潜在作用,并为 NK 细胞免疫疗法的合理设计提供了参考。
6. TME 中塑造肿瘤浸润 NK 细胞功能的潜在介质
为了深入了解 NK 细胞在 TME 中的调控程序,我们利用 CellPhoneDB 来探测 NK 细胞和其他 CD45+ 免疫细胞(包括 T 细胞和髓系细胞)之间潜在的细胞 - 细胞相互作用。与 T 细胞相比,除肥大细胞外,大多数髓系细胞类型与 CD56dimCD16hi NK 亚群表现出强烈的潜在相互作用(图 6A)。特别有趣的是,TaNK 细胞被预测通过 ANXA1 调节多种髓系细胞类型,ANXA1 是一种在炎症反应中与免疫抑制和诱导巨噬细胞重编程相关的蛋白质(图 6B)。这表明功能失调的 NK 细胞可能具有抑制 TME 中促炎巨噬细胞的潜力。为了进一步阐明 NK 细胞来源的 ANXA1 在巨噬细胞中的作用,我们对肺癌和肝癌的肿瘤样本进行了多重免疫荧光染色,发现了一个 ANXA1+ NK 细胞群。与远离 ANXA1+ NK 细胞的巨噬细胞相比,靠近 ANXA1+ NK 细胞的巨噬细胞表现出较低的活化标志物 CD86(图 6C-D) 和较高的抗炎标志物转化生长因子 b (TGF-b) 的表达水平(图 6E-F)。
值得注意的是,在树突状细胞(DC) 亚群中,LAMP3+ DC,最近表征的成熟 cDCs(也称为 mregDC) 显示出与 CD56dimCD16hi NK 细胞最强的相互作用潜力(图 6A)。多重免疫荧光分析显示,LAMP3+ DCs 与 NK 细胞共定位(图 6J)。此外,预测它们之间的相互作用通过 IL-15-IL-15 受体和 NECTIN2-TIGIT 相互作用轴介导(图 6B)。重要的是,LAMP3+ DC 在转录组水平上表达免疫群体中最高水平的 IL15、PVRL2 (NECTIN2) 和 PVR(图 6G)。流式细胞术也证实了 IL-15 在 LAMP3+ DC 中的高表达(图 6H)。IL-15 已被确定为维持 NK 细胞寿命的稳态相关细胞因子,并用于 NK 细胞输注和体外繁殖。相比之下,TIGIT 作为抑制受体有助于抑制 NK 细胞介导的免疫反应。此外,在 TCGA 数据集中,LAMP3+ DC 的丰度与 CD56dimCD16hi NK 细胞相关(图 6I)。接下来,我们研究了 LAMP3+ DC 在肿瘤中的具体调控过程,发现肿瘤浸润的 LAMP3+DC 与邻近非肿瘤组织相比,IL15 的表达较低(图 S6K),这表明 LAMP3+ DC 可能对 TME 中 CD56dimCD16hi NK 细胞的激活作用受损。事实上,物理上接近 LAMP3+ DC 的 NK 细胞表达颗粒酶 B 的水平较低(图 6J-K)。总之,我们的分析表明,在 TME 中,LAMP3+ DC 对 CD56dimCD16hi NK 细胞的异常调节。

7. 外周血 NK 细胞亚群的不同转录组模式
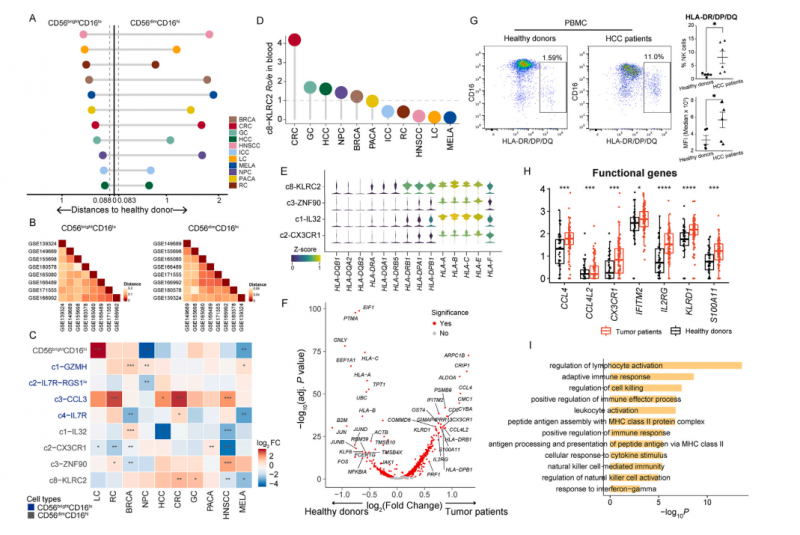
NK 细胞在血液中的淋巴细胞室中占相当大的比例,但它们在肿瘤诱导的外周免疫系统中的作用相对不明确。我们的图谱包含来自 35 名健康供者的血液来源 NK 细胞的 9 个 scRNA 数据集,使我们能够探测肿瘤患者外周血中 NK 细胞的特异性改变。
我们首先比较了来自健康供者的循环 NK 细胞与来自肿瘤患者的循环 NK 细胞的转录组特征,不同数据集的健康供者的循环 NK 细胞显示出高度相似性(图 7B)。相比之下,对于来自肿瘤患者的循环 CD56brightCD16lo 细胞,我们观察到与健康供者的转录组存在显著差异;在所分析的所有癌症类型中,循环 CD56dimCD16hi 细胞的差异甚至更为显著(图 7A)。值得注意的是,肿瘤患者在 NK 细胞亚群中表现出显著的组成变化,这种模式似乎是癌症类型特异性的(图 7C)。例如,在结直肠癌、头颈部鳞状细胞癌、肾癌和 HCC 中,循环 CD56brightCD16lo c3-CCL3 NK 细胞的比例增加,但在其他被分析的癌症类型中没有增加。
接下来,我们将重点放在 CD56dimCD16hi c8-KLRC2 适应性 NK 细胞上,该细胞在某些癌症类型如结直肠癌和胃癌中富集(图 7D)。适应性 NK 细胞被认为是 CAR NK 细胞的一个有吸引力的来源,因为它们具有增强细胞因子反应的效应特性和对免疫抑制效应的内在抗性。特别有趣的是,根据我们的数据,与其他循环 NK 细胞相比,这些细胞特异性表达 MHC II 类基因(图 7E)。我们还检查了这些 NK 细胞在肿瘤患者中的功能变化,发现与健康供体相比,患者来源的适应性 NK 细胞的功能基因和 MHC II 类基因的表达明显更高(图 7F, 7H),这意味着它们在肿瘤患者中处于高度激活状态。我们通过流式细胞术进一步证实,与健康供者相比,HCC 患者循环 NK 细胞中 MHC II 类分子的高表达(图 7G)。因此,在患者源性适应性 NK 细胞中上调的基因参与了免疫效应过程的正调控等途径(图 7I)。综上所述,我们的分析表明,循环 NK 细胞参与了肿瘤进展过程中外周免疫环境的系统性变化。
结论
NK 细胞在对抗肿瘤进展的先天免疫应答中起着不可或缺的作用。为了描述他们在肿瘤微环境中的表型和功能多样性,我们对 716 名癌症患者的 NK 细胞做了综合的单细胞 RNA 测序分析,涵盖了 24 种癌症类型。我们在肿瘤类型特异的种类中观察到 NK 细胞组成的异质性。值得注意的是,我们鉴定出了一组肿瘤相关的 NK 细胞,他们在肿瘤中富集,显示出抗肿瘤功能受损,并与不良预后及免疫治疗耐受有关。特定的髓系细胞亚群,特别是 LAMP3+DC 细胞,可能介导 NK 细胞抗肿瘤免疫的调节。总之,我们的综合分析增强了目前从泛癌症角度对 NK 细胞的理解,阐明了 NK 细胞群体结构以及肿瘤诱导的局部和全身 NK 细胞反应的见解。为了方便广泛的研究社区使用我们的数据,已经开发了一个交互式门户网站(http://pan-nk.cancer-pku.cn/) 来分析和可视化我们的单细胞数据。我们设想我们的大规模数据可以进一步促进 NK 细胞免疫疗法在更多癌症患者中的应用。
参考文献:
Tang F, Li J, Qi L, Liu D, Bo Y, Qin S, Miao Y, Yu K, Hou W, Li J, Peng J, Tian Z, Zhu L, Peng H, Wang D, Zhang Z. 2023. A pan-cancer single-cell panorama of human natural killer cells. Cell, 186(19):4235-4251. doi: 10.1016/j.cell.2023.07.034.

